噬菌体展示(phage display)是一种利用实验室进化,高通量、高内涵地淘选具有特定结合能力的多肽或抗体的分子生物学技术,已广泛用于生物医药、新材料、新能源及环保相关的基础与应用研究中。不少从噬菌体展示文库中筛到的多肽与抗体已开发成为新药。例如:治疗血小板减少的肽体药物罗米司亭(romiplostim, Nplate®)[1];治疗类风湿性关节炎、强直性脊柱炎、银屑病,年销售超过180亿美元的抗体药物阿达木单抗(adalimumab, HUMIRA®)[2]。噬菌体展示不仅已在新药研究中大展宏图,而且也在新疫苗[3]、新诊断试剂[4]研究中崭露头角。除了助力人类健康事业,近年来用半导体进行噬菌体展示研究的成果在锂离子电池等新能源研究中大放异彩[5],用重金属离子进行噬菌体展示研究的成果显示了它在污染治理领域中也大有用武之地[6]。2018年,噬菌体展示研究的两位先驱,美国科学家乔治·史密斯(George P. Smith)和英国科学家格雷格·文特(Gregory P.Winter)荣获诺贝尔化学奖。这里,谨对噬菌体展示实验技术的发展进行扼要介绍。
噬菌体(phage)是一类感染细菌的病毒。如图1所示,有些噬菌体,如丝状噬菌体M13、fd、f1等,是非常好的表达载体。通过基因工程方法,可以将外源基因片段或随机DNA序列插入噬菌体基因III或VIII中,表达后形成的融合蛋白仍能够自主装配成噬菌体外壳并将外源蛋白或多肽展示在噬菌体颗粒表面。由于噬菌体易于培养,增殖迅速。因此,通过随机PCR等分子生物学技术,可以很方便地构建多样性从数百万到数百亿的噬菌体文库(phage library)。
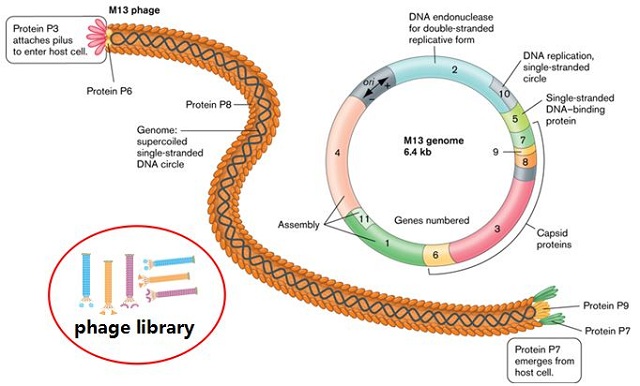
图1:基于M13噬菌体构建噬菌体展示文库示意图
利用噬菌体的上述特点,美国密苏里大学的乔治·史密斯教授于1985年开创性地提出了噬菌体展示技术[7],使得研究者可以像钓鱼一样从鱼塘(噬菌体文库)中钓到能与鱼饵(bait)结合的展示了特定多肽的噬菌体。通常,用来筛选噬菌体文库的物质被称为靶标(target)。如图1所示,使用抗体、受体、酶、化合物、半导体材料等靶标,经过几轮结合、洗脱、增殖的循环淘选(生物淘选,biopanning),常常能从文库中筛出一些与靶标特异性结合的噬菌体;通过DNA测序即可推导确定所展示多肽的氨基酸序列。1990年,格雷格·文特将噬菌体展示技术成功地从多肽的展示与筛选扩展到抗体的展示与筛选,人类从此进入了不经过免疫也能获得特异性抗体的时代[8]。由于这些模拟了自然选择与进化的循环筛选过程都是基于噬菌体展示肽库或抗体库并在体外进行的,因此被称为体外噬菌体展示(in vitro phage display)。2002年,Smoother将上述体外噬菌体展示做了总结(见图2)并发表在Science杂志上[9]。
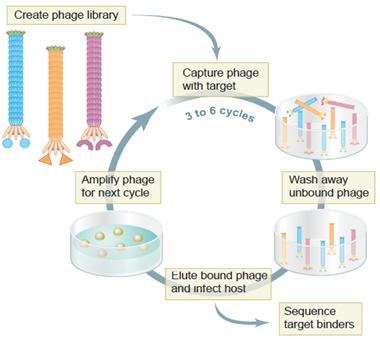
图2:体外噬菌体展示技术示意图[9]
1996年,Pasqualini博士独辟蹊径,将噬菌体展示的多肽文库从尾静脉注射到小鼠体内,进而成功筛选出能够靶向到肿瘤或特定器官的多肽[10]。如图2所示,该方法循环筛选的过程类似经典噬菌体展示,但由于是在动物体内进行的,因此又被称为体内噬菌体展示(in vivo phage display)[11]。
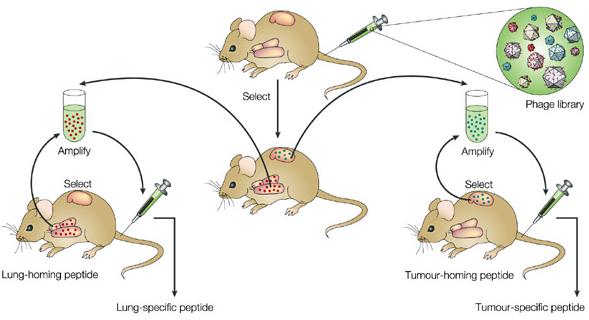
图3:体内噬菌体展示技术示意图[11]
近年来,噬菌体展示实验技术与时俱进,新的进展很多。这里总结为三点。首先是噬菌体展示肽库从随机多肽库、抗体库进一步扩展到了人类多肽组,并成功用于确定与疾病密切相关的自身免疫抗原[12]。其次是第二代DNA测序技术开始用于噬菌体展示[13]。最后是噬菌体辅助连续进化(phage-assisted continuous evolution, PACE)[14]及微流控噬菌体展示(microfluidic phage display)[15]等新方法或硬件系统的问世、发展与广泛应用。例如,噬菌体辅助连续进化技术已成功用于基于Cas9的基因组编辑工具的优化[16]。
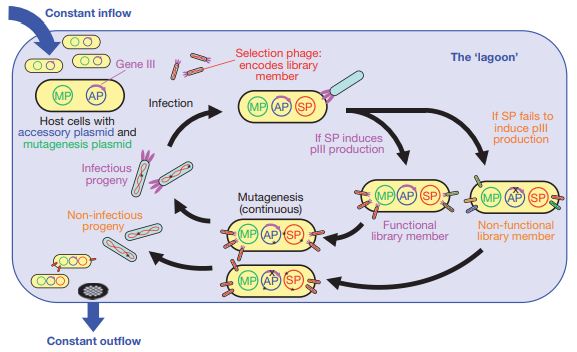
图4:噬菌体辅助连续进化系统示意图[14]
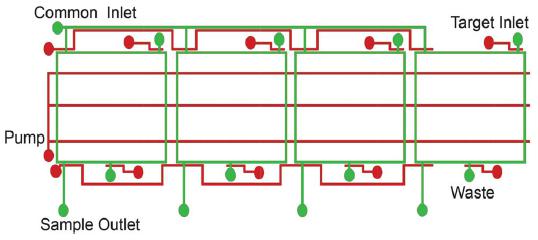
图5:一种微流控噬菌体展示系统示意图[15]
参考文献
Yang AS: Development of Romiplostim: A Novel Engineered Peptibody. Semin Hematol 2015, 52(1): 12-15.
Olivieri I, D'Angelo S, Palazzi C, Padula A: Advances in the management of psoriatic arthritis. Nature Reviews Rheumatology 2014, 10: 531–542.
O'Rourke JP, Daly SM, Triplett KD, Peabody D, Chackerian B, Hall PR: Development of a mimotope vaccine targeting the Staphylococcus aureus quorum sensing pathway. PLoS One 2014, 9(11): e111198.
Hsiung PL, Hardy J, Friedland S, Soetikno R, Du CB, Wu AP, Sahbaie P, Crawford JM, Lowe AW, Contag CH, et al.: Detection of colonic dysplasia in vivo using a targeted heptapeptide and confocal microendoscopy. Nature Med 2008, 14: 454-458.
Lee YJ, Yi H, Kim WJ, Kang K, Yun DS, Strano MS, Ceder G, Belcher AM: Fabricating genetically engineered high-power lithium-ion batteries using multiple virus genes. Science 2009, 324: 1051-1055.
Nguyen TT, Lee HR, Hong SH, Jang JR, Choe WS, Yoo IK: Selective lead adsorption by recombinant Escherichia coli displaying a lead-binding peptide. Appl Biochem Biotechnol 2013, 169(4): 1188-1196.
Smith GP: Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface. Science 1985, 228: 1315-1317.
McCafferty J, Griffiths AD, Winter G, Chiswell DJ: Phage antibodies: filamentous phage displaying antibody variable domains. Nature 1990, 348: 552-554.
Smothers JF: Affinity selection from biological libraries. Science 2002, 298: 621-622.
Pasqualini R, Ruoslahti E: Organ targeting in vivo using phage display peptide libraries. Nature 1996, 380: 364-366.
Ruoslahti E: Specialization of tumour vasculature. Nature Rev Cancer 2002, 2:83-90.
Robinson WH, Steinman L: Human peptidome display. Nat Biotechnol 2011, 29:500-502.
Matochko WL, Derda R: Next-generation sequencing of phage-displayed Peptide libraries. Methods Mol Biol 2015, 1248: 249-66.
Esvelt KM, Carlson JC, Liu DR: A system for the continuous directed evolution of biomolecules. Nature 2011, 472: 499-503.
Cung K, Slater RL, Cui Y, Jones SE, Ahmad H, Naik RR, McAlpine MC: Rapid, multiplexed microfluidic phage display. Lab Chip 2012, 12: 562-565.
Hu JH, Miller SM, Geurts MH, Tang W, Chen L, Sun N, Zeina CM, Gao X, Rees HA, Lin Z, Liu DR: Evolved Cas9 variants with broad PAM compatibility and high DNA specificity. Nature 2018, 556(7699): 57-63.